4月30日,国际学术期刊Nature Communications在线发表了中科院上海营养与健康研究院孙宇研究组题为The senescence-associated secretory phenotype is potentiated by feedforward regulatory mechanisms involving Zscan4 and TAK1 的最新研究成果,文章报道了由药物毒副作用引发DNA损伤效应在临床治疗过程中引发体内细胞发生被动衰老,并在诱导衰老细胞出现一种强烈、持续和长期的分泌表型(senescence-associated secretory phenotype,SASP,衰老相关分泌表型)过程中的关键作用。
长期以来,化疗、放疗、手术治疗以及靶向治疗等手段是临床医生对于肿瘤患者采取的主要治疗方式;其中,带有胁迫性DNA损伤的放、化疗手段是生理水平影响最深远、临床最常见、对患者治疗效果影响最显著的一种结构性和物理性伤害。研究表明,相比于临床常用的非基因毒药物如长春碱、紫杉烷类,直接或者间接性导致DNA损伤的各类烷化剂、铂类等化疗药物或者基于 射线的放疗方式,可以在造成细胞衰老的同时,高频激发细胞的SASP表型;这种SASP表型在肿瘤患者抗癌治疗的过程中对于癌细胞的增殖、侵袭、耐药甚至是转移等恶性特征有着推波助澜的作用。
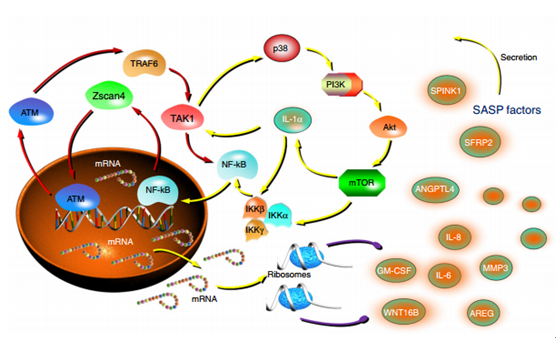
博士研究生张博逸等在孙宇研究员的指导下,利用高通量基因芯片(whole genome expression analysis)技术在人源前列腺基质细胞中发现,相比于非DNA 损伤组,DNA损伤组处理导致的衰老细胞中,SASP特征性因子(SPINK1、IL-8、SFRP2等)表达幅度更高,而在这组表达谱中居于第一位的Zscan4作为一种核质蛋白引起了研究组的极大兴趣。研究发现,在大量的乳腺癌(BCa)和非小细胞肺癌(NSCLC)临床病患样本中,组化分析数据显示相比于化疗前阶段,患者化疗后阶段病灶中Zscan4显著上调,且Zscan4在患者癌组织中的表达,集中体现于腺体周边的基质细胞,而非腺体内的上皮细胞。更有意思的是,Zscan4在肿瘤患者基质细胞中的表达水平越高,临床预后越差,总体生存期越短,暗示Zscan4具有重要的临床病理学意义。进一步的研究发现基质细胞在DNA损伤条件诱导下出现的高表达Zscan4,对于ASAP(acute stress associated phenotype,急性胁迫相关表型)向SASP的过度起到关键作用,而在急性阶段发生活化的TAK1则是介导这一过程的桥梁。活化TAK1可以在胞质中激活p38,后者通过 PI3K/Akt/mTOR信号通路,激活IL-1 /NF-kB这一positive feedback loop,进而使SASP炎症反应进一步级联放大。团队基于这一发现,在随后的研究中将基质细胞和癌细胞共同移植到体内形成移植瘤模型,由化疗药物和SASP抑制剂构成的组合治疗方案,可以更加有效地引起肿瘤消退。相比于p38抑制剂SB203580和mTOR抑制剂RAD001,TAK1抑制剂5Z-7-OX提供的治疗效果更加显著,并且可以显著延长负瘤小鼠的有效生存期。该项研究为肿瘤的治疗提供了临床医学实现精准化和个性化的新思路和治疗靶标。
该课题得到了美国MD Anderson Cancer Center 的Paul Chiao教授、英国Imperial College London的Eric Lam教授,苏州大学医学部秦樾教授等人的大力帮助。该项研究获得中国国家基金委、科技部和中科院等机构的基金资助。