2019年9月7日,中国科学院上海营养与健康研究所孙宇组在Aging Cell杂志上发表了题为“Targeting amphiregulin (AREG) derived from senescent stromal cells diminishes cancer resistance and averts programmed cell death 1 ligand (PD‐L1)-mediated immunosuppression”的论文。该研究发现,人源基质细胞在化疗过程中会被动进入衰老状态,发展为典型SASP的同时生成与释放一种名为AREG (amphiregulin,双向调节素)的外泌因子,持续不断地进入受损的微环境空间。AREG一方面促进病灶中残存癌细胞恶性表型并导致其获得耐药性,从而造成临床治疗抵抗;另一方面诱导癌细胞上调表达PD-L1,形成免疫抑制性微环境,使得癌细胞逃逸免疫监控。此外,外周血中AREG可通过常规技术实时检测,其含量的动态变化同患者生存密切相关,可作为将来临床预后与疗效评价的一个精确指标。
AREG作为一种生长因子可以参与调控多种生理过程,包括乳腺导管、卵母细胞、胚囊和骨组织的发育和成熟等。已有报道AREG广泛表达于多种肿瘤组织,包括乳腺癌、肺癌、结直肠癌、卵巢癌、前列腺癌及胰腺癌等,具有显著促癌活性。在一些特殊场合,AREG可参与调控免疫抑制过程,如炎症条件下的Foxp3+ Treg cell表达EGFR,而AREG体外可以显著提高Treg cell的功能;在colitis和肿瘤免疫模型中mast cell衍生的AREG可以彻底恢复Treg cell的活性,靶向这一免疫调控机制有可能促进那些靶向癌症病人体内EGFR为治疗依据的成功率。
研究人员发现相比于同器官来源的上皮癌细胞,以成纤维细胞为主要成分的基质组织在基因毒药物作用下更加显著地合成与外泌AREG。其转录和翻译均呈时间依赖性,即在细胞进入深度衰老阶段后方达到高峰期。该SASP因子在多个人源基质细胞系中的表达十分类似,即在多组织、多器官中均具胁迫响应性。体外数据表明,衰老基质细胞通过激活转录因子NF- B结合到AREG基因的启动子区域,增强AREG的转录,从而上调表达AREG。衰老基质细胞来源的AREG能够结合并活化前列腺癌细胞表面受体EGFR,进而激活下游促癌信号通路Akt-mTOR和Mek-Erk并磷酸化Stat3。通过在基质细胞中过表达或敲除AREG,发现基质细胞来源的AREG显著促进癌细胞的增殖率、迁移率和侵袭性。更重要的,基质AREG造成上皮癌细胞出现显著耐药性,其剂量反应曲线出现明显的平行漂移。此外,基质AREG促进上皮癌细胞表达PD-L1,造成癌细胞免疫逃逸,敲除PD-L1能够有效促进免疫细胞对癌细胞杀伤作用。
动物实验中,以MIT为主的化疗药物可以造成癌细胞的终端体积显著下降;但在基质细胞同时存在的情况下,肿瘤滞留体积却大幅上升,暗示微环境在治疗过程中赋予残存癌细胞显著的耐药性。化疗药物给药荷瘤小鼠的过程中,一些SASP典型外泌因子如IL6、IL8、WNT16B、SFRP2的表达均出现上调,暗示体内条件下细胞衰老和SASP的出现。研究人员注射人源PBMC并重构了免疫完整型小鼠(Rag2-/-IL-2R null),发现MIT协同PD-L1/PD-1阻断剂给药可以进一步缩小肿瘤终端体积,暗示微环境中的AREG同时能够赋予癌细胞免疫逃逸的能力。
该研究的亮点在于第一次揭示肿瘤微环境内的基质细胞在化疗过程中可以生成与释放大量的SASP因子,其中的AREG可以激活疗后阶段残存下来的癌细胞,使其获得对于临床药物的抵抗;同时,AREG塑造了临床背景下的免疫抑制性微环境,从而使得癌细胞能够逃脱细胞毒T细胞、巨噬细胞等免疫亚群的攻击。这种获得性耐药和免疫逃逸,正是造成日后肿瘤复发和转移的病理基础。
博士生许奇霞和复旦大学中山医院泌尿外科龙启来为该文共同第一作者,孙宇研究员为通讯作者。该研究得到了美国Buck衰老研究所Judith Campisi教授等人的帮助,相关工作在科技部、自然科学基金委、中组部等国家机构的共同资助以及上海营养与健康研究所公共技术平台的支持下完成。(科技处)
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1111/acel.13027
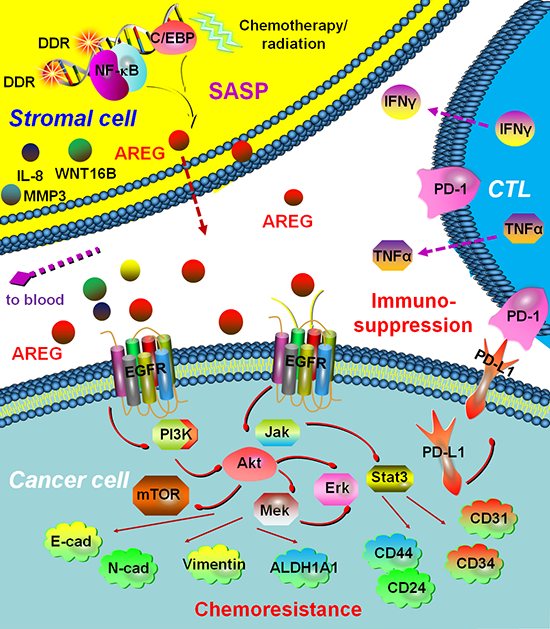
(图注: 微环境中的基质细胞在化疗损伤背景下进入衰老状态并合成、释放SASP外泌因子AREG,导致癌细胞获得性耐药并形成免疫抑制性微环境,最终加速疾病恶化进程。)