2019年6月10日,《自然》Nature杂志在线发表了题为“Off-target RNA mutation induced by DNA base editing and its elimination by mutagenesis”的研究论文,该研究由中科院神经科学研究所、脑科学与智能技术卓越创新中心杨辉研究组、四川大学华西二院/生命科学学院郭帆研究组和中国科学院上海营养与健康研究所隶属的计算生物学研究所(中国科学院-马普学会计算生物学研究所)李亦学研究组合作完成,该研究发现DNA单碱基编辑工具CBE和ABE均存在大量的RNA脱靶效应,相比于仅有GFP处理的对照组,CBE或ABE处理的细胞的RNA SNV平均增加了15倍之多。研究者通过一系列分析证明这些RNA脱靶产生的单核苷酸突变与目的编辑位点没有序列相似性,而主要是由于DNA单碱基编辑器的脱氨酶APOBEC1 (BE3)和TadA (ABE)所导致的。此外,团队还发现很高比例的RNA脱靶发生在癌基因和抑癌基因上,如果用于临床治疗有较大的致癌风险。结合今年3月在《科学》杂志报道单碱基编辑技术BE3存在全基因组范围内的DNA脱靶效应,该项研究发现了单碱基编辑工具还存在无法预测的RNA脱靶,加强了世人对单碱基编辑工具的安全性的审视。
为了获得更加精准的单碱基编辑工具,研究团队通过引入突变的方法对两种DNA单碱基编辑器的胞嘧啶脱氨酶和腺嘌呤脱氨酶分别进行了优化,最终获得了3种高保真度的BE3突变体,均能够完全消除RNA脱靶并维持DNA编辑活性的高精度单碱基编辑工具。针对ABE系统,根据降低脱氨酶TadA*的RNA结合活性的思路进行点突,在降低RNA脱靶现象的同时维持了其在DNA上的编辑活性。此外,团队开发的ABE(F148A)突变体还能够缩小编辑窗口,实现更加精准的DNA编辑。该技术在特异性和精确性上超越了ABE7.10,结合之前的研究ABE并不造成DNA上的脱靶,该突变体有望在未来成为一种更加安全、更加精准的基因编辑工具,应用于临床治疗中。
上述工作是众多课题组共同合作的重要成果,得到神经所流式分选平台,巴斯德所流式分选平台的大力协助。本工作得到国家高科技研发项目,中科院战略性先导科技专项,国家自然科学基金委员会和上海市科学技术委员会等项目的资助。(科技处)
原文链接:https://www.nature.com/articles/s41586-019-1314-0
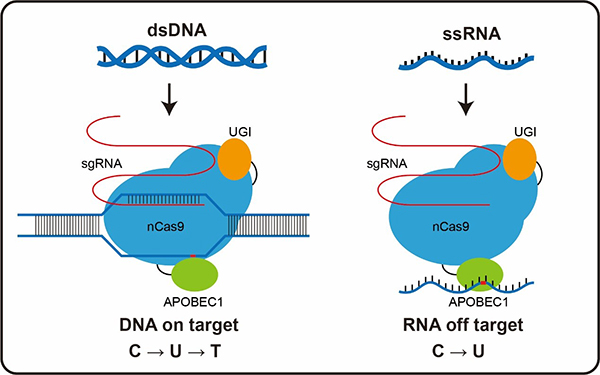
图注单碱基编辑器BE3中的脱氨酶除了诱导DNA的胞嘧啶脱氨基转变成T,还能在RNA上造成大范围的脱靶。