2月7日,国际学术期刊Nature Communications在线发表了中国科学院上海营养与健康研究所李于研究组的最新研究成果“Post-translational regulation of lipogenesis via AMPK-dependent phosphorylation of insulin-induced gene”。该研究发现腺苷酸活化蛋白激酶(AMPK)通过磷酸化增加内质网锚定蛋白Insig的活性,进而抑制肝脏脂质合成的功能,揭示了蛋白质翻译后修饰通过泛素化降解途径调节脂肪酸合成的新机制。
随着生活方式和饮食结构的改变,非酒精性脂肪肝病在全球范围所占比例越来越高,并且近年来其发病率呈上升趋势。非酒精性脂肪肝与2型糖尿病、肥胖以及心血管疾病等重大代谢性疾病的发生发展密切相关。肝脏脂肪酸从头合成的增加在非酒精性脂肪肝的发生发展过程中扮演着重要角色。AMPK是真核生物主要的能量感应因子,在能量应激的情况下感应细胞内升高的AMP:ATP和ADP:ATP水平,通过抑制合成代谢,促进分解代谢使能量达到稳态。AMPK作为机体重要的能量感应因子,调控着蛋白质、脂肪和糖代谢等过程。二甲双胍是临床中治疗2型糖尿病的首选药物,能够通过激活AMPK改善机体糖脂代谢紊乱。二甲双胍在改善肝脏脂质沉积,降低人的非酒精性脂肪肝病方面同样具有良好的效果,但其作用分子机制仍需要进一步阐明。
带着这一科学问题,李于团队博士研究生韩亚美、胡志敏等人构建了二甲双胍给药的饮食诱导的肥胖小鼠模型,通过筛选小鼠肝脏中的差异蛋白,发现二甲双胍处理能够在激活AMPK的同时显著地增加肝脏细胞内锚定于内质网的Insig-1和Insig-2的蛋白水平,与肝脏内甘油三脂含量呈负相关。通过进一步的研究发现,AMPK能够磷酸化修饰Insig,抑制Insig与E3泛素连接酶gp78的相互作用,通过抑制Insig泛素化水平和蛋白酶体降解途径,增加其蛋白稳定性;进而抑制SREBP-1的剪切活化,降低脂质合成基因表达和肝细胞脂质积累。蛋白质谱检测和生化分析表明,Thr222位点介导了AMPK对Insig-1活性增强的作用,以及对SREBP-1剪切和脂质合成基因表达水平的抑制作用。同时,研究人员发现利用腺病毒过表达Insig-1可以缓解肝脏特异性AMPK 2缺失引起肝脏脂质沉积增加的作用。这些研究表明Insig是AMPK新的靶蛋白,在介导二甲双胍-AMPK信号通路抑制肝脏脂质从头合成过程中起重要作用。
最近,李于团队发现新型代谢因子CREBZF能够感应胰岛素信号,通过抑制Insig的转录水平,从而使胰岛素发挥促进肝脏脂质合成的功能,从而揭示了肝脏中为什么会发生选择性胰岛素抵抗的科学问题(Zhang F, et al, Hepatology, 2018);另外,发现AMPK能通过磷酸化SREBP,抑制肝脏脂质合成(Li Y, et al, Cell Metabolism, 2011)。在生理条件下,这些复杂的营养感应机制和代谢调控途径,可以有效维持机体在能量缺乏或者充足条件下的脂代谢动态平衡;然而,在长期肥胖和营养过剩条件下,这些代谢调控分子网络受阻或紊乱,引起肝脏脂代谢失衡和功能障碍,导致非酒精性脂肪肝、胰岛素抵抗和2型糖尿病。这些研究成果表明,CREBZF和AMPK介导的Insig转录调控和翻译后修饰在脂质代谢中起关键作用,为临床治疗非酒精性脂肪肝提供新的治疗策略。
该研究得到了武汉大学宋保亮教授、上海交通大学附属新华医院范建高教授、中科院上海药物所李佳和李静雅研究员、中科院上海营养与健康研究所方靖研究员、浙江工业大学魏春教授的支持和帮助。该项目得到了国家科技部重点研发计划、国家自然科学基金委、中科院科研基金、王宽诚教育基金等的支持。
博士研究生韩亚美、胡志敏为论文共同第一作者,中科院上海营养与健康研究所李于研究员为通讯作者。 (科技处)
研究论文链接:https://www.nature.com/articles/s41467-019-08585-4
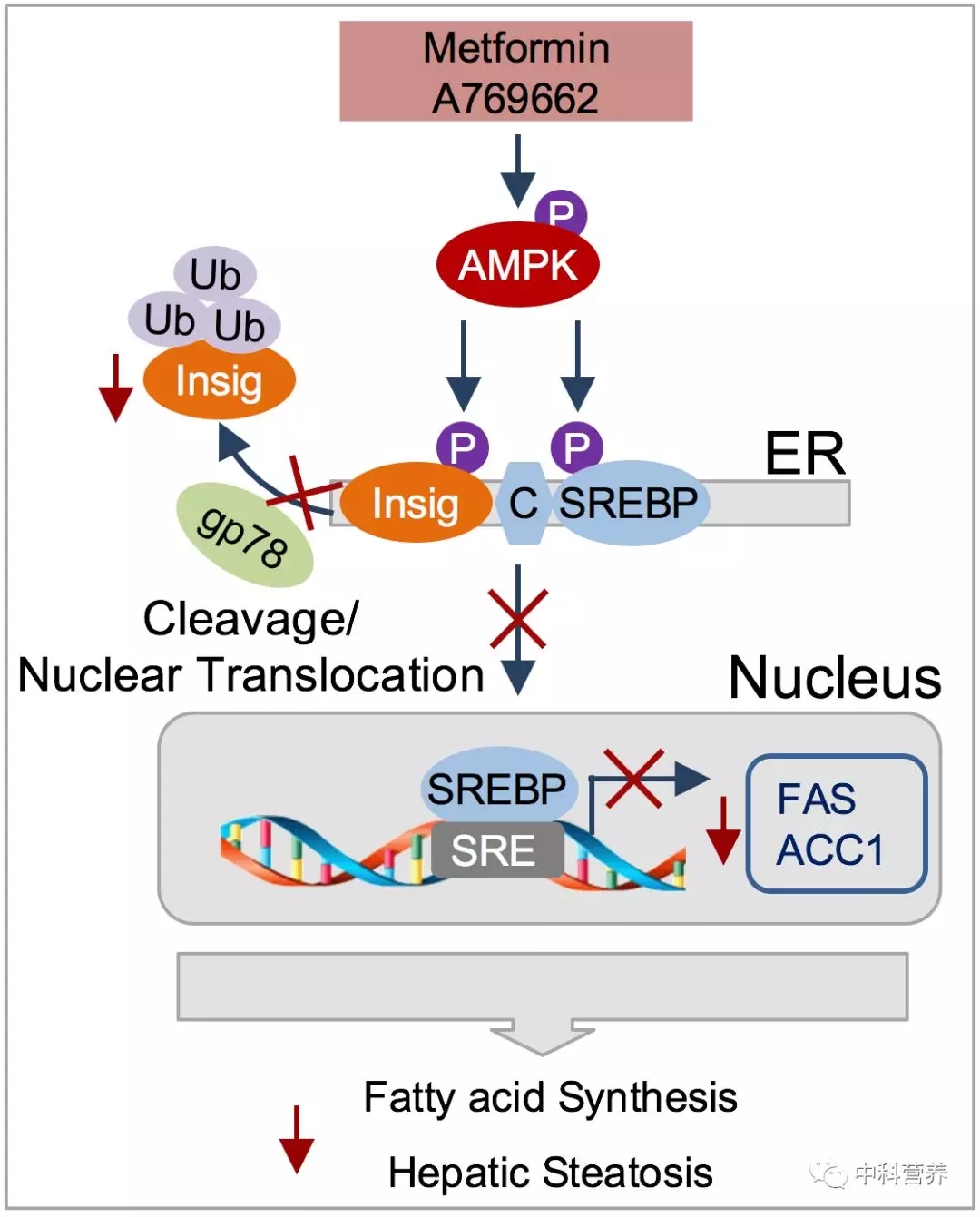
AMPK通过磷酸化修饰Insig调节脂肪酸合成
二甲双胍、A769662等在激活AMPK的情况下,能够磷酸化Insig-1 Thr222位点,抑制其与E3泛素连接酶gp78的相互作用,降低泛素化水平,从而增加蛋白稳定性,抑制SREBP的剪切和活化,进一步抑制脂质合成基因表达和肝脏脂肪酸合成,改善肝脏脂质沉积和脂肪肝。本研究揭示了蛋白质翻译后修饰通过泛素化降解途径调节脂肪酸合成的新机制,为临床中治疗非酒精性脂肪肝和相关代谢性疾病提供了新靶点和新思路。