11月14日,国际学术期刊Journal of Biological Chemistry在线发表了中国科学院上海营养与健康研究院李于研究组的研究论文“The ER-localized Ca2+-binding protein calreticulin couples ER stress to autophagy by associating with microtubule-associated protein 1A/1B light chain 3”,该研究通过动物实验和细胞实验首次发现一种内质网分子伴侣Calreticulin通过增强细胞自噬途径降解错误折叠蛋白质,从而缓解内质网应激。这一调控机制的发现为分子伴侣蛋白维持细胞内稳态的作用和机制提供了新认识。
内质网作为蛋白质加工的重要场所,其稳态对于维持蛋白质代谢平衡有至关重要的作用。内质网内未折叠或错误折叠的蛋白质的过度滞留会引起内质网应激。持续高水平的内质网应激与多种代谢性疾病的发生和进展密切相关,如肥胖、胰岛素抵抗、2型糖尿病、脂质代谢异常等。因此,维持蛋白质稳态,降低内质网应激水平可作为代谢性疾病的潜在治疗靶点。自噬作为细胞清除内质网错误折叠蛋白的重要途径之一,其与内质网应激的相互作用及其分子机制目前尚不清楚。
博士研究生杨云志和马风光等人在李于研究员的指导下,在衣霉素(tunicamycin)诱导的内质网应激动物模型及细胞模型中发现内质网伴侣蛋白Calreticulin表达上调,同时伴随细胞自噬水平增强。研究人员通过保守区域一级序列预测及蛋白质免疫共沉淀实验发现了Calreticulin可与自噬关键蛋白LC3相互作用,并确定了其与LC3相互作用的位点。在药物诱导的内质网应激条件下,Calreticulin和LC3的相互作用增强。在体外培养的HeLa细胞中过表达Calreticulin可使细胞自噬水平增强,同时药物诱导的内质网应激得到缓解;而通过shRNA敲减Calreticulin则导致内质网应激条件下自噬无法有效激活,进一步加剧了内质网应激水平。这些结果揭示了内质网分子伴侣Calreticulin通过激活自噬缓解内质网应激的分子机制,为治疗相关代谢性疾病提供了新的思路和策略。
李于研究员长期从事糖尿病及非酒精性脂肪性肝病研究。课题组近期研究发现:新型代谢调节因子CREBZF可能是治疗非酒精性脂肪肝合并胰岛素抵抗的新靶点(Hepatology, 2018);黄连中活性成分小檗碱通过肝脏和脂肪组织间的对话机制来降低肥胖的新理论(Sun Y, et al, British Journal of Pharmacology, 2018)。
该项目得到国家科技部重点研发计划、国家自然科学基金委、中科院和王宽诚教育基金的支持。 (科技处)
研究论文链接:http://www.jbc.org/content/early/2018/11/14/jbc.RA118.005166.abstract
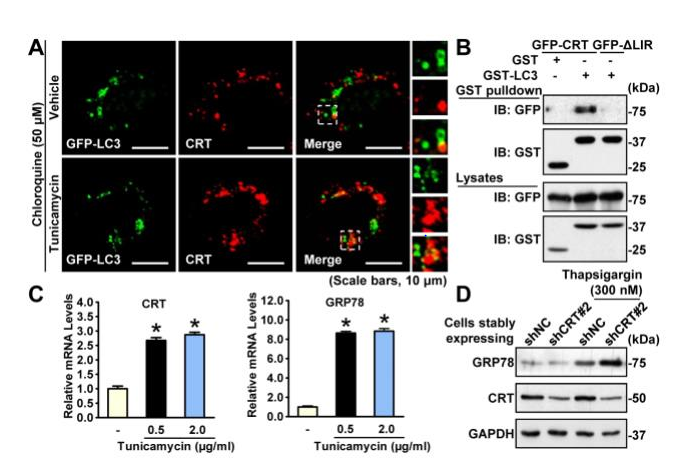
内质网伴侣蛋白-自噬途径负反馈调节内质网应激反应
在内质网应激(ER stress)条件下,Calreticulin受非折叠蛋白反应(UPR)的诱导表达上调,高表达的Calreticulin通过保守的LIR序列与自噬相关蛋白LC3相互作用,激活细胞自噬途径,从而降解累积的异常折叠蛋白,缓解细胞应激水平。该研究表明激活Calreticulin-自噬途径可能会成为治疗内质网应激及相关代谢疾病的新策略和靶点。