5月14日,中国科学院上海营养与健康研究所钱友存研究组,联合中国科学院分子细胞科学卓越创新中心宋昕阳研究组,在Nature杂志在线发表了题为“Targeting symbionts by apolipoprotein L proteins modulates gut immunity”的研究成果。该研究首次揭示了小鼠肠道上皮细胞(Intestinal epithelial cells, IECs)分泌的载脂蛋白APOL9a/b及其人源同源蛋白APOL2可特异性识别拟杆菌目(Bacteroidales)细菌,诱导其释放外膜囊泡(Outer membrane vesicles, OMVs),并激活宿主免疫因子IFN-γ-MHC-II信号通路,从而提升肠道黏膜屏障的抗感染能力。这项研究揭示了宿主免疫系统通过精细机制调控肠道微生态平衡,拓展了对宿主与共生菌共同进化互作机制的理解,为菌群相关疾病的精准干预与治疗策略创新奠定了理论基础。
哺乳动物肠道是宿主与共生微生物互作的核心界面。肠道微生物来源的代谢产物(如胆汁酸、短链/长链脂肪酸)及膜结构分子(如多糖A、α-半乳糖神经酰胺)等生物活性小分子可跨越肠道上皮屏障,进而调控宿主免疫细胞分化与功能。例如,诱导结肠调节性T细胞(Regulatory T cells, Tregs)分化或促进小肠上皮内淋巴细胞(Intraepithelial lymphocytes, IELs)的聚集。与此同时,宿主则通过上皮黏液屏障、抗菌蛋白(Anti-microbial peptides, AMPs)、分泌型免疫球蛋白(Secretory immunoglobulin A, sIgA)及补体成分(如Complement 3,C3)等防御机制维持菌群稳态。然而,现有研究主要聚焦于广谱性、非特异性的防御策略,对于宿主是否具备选择性识别并调控特定共生菌群成员的能力仍缺乏深入理解。
为了系统挖掘宿主调控肠道菌群的关键分子,研究人员首先借助高通量蛋白质组学技术,对常规饲养(Conventional raised, CR)小鼠和无菌(Germ-free, GF)小鼠回肠黏液层中的蛋白质组成进行了全面对比分析。通过筛选菌群依赖性表达上调的蛋白质,并利用CR小鼠中回肠共生菌群结合蛋白的蛋白质组进行联合分析,研究人员最终聚焦于一类此前功能未明的脂蛋白家族成员——Apolipoprotein L9a/b(APOL9a/b, 或APOL9),并确认其表达受菌群调控。同时,单细胞测序及免疫荧光分析显示APOL9a/b主要来源于肠上皮吸收细胞(Enterocyte)。为探明其靶向的共生菌是否具有微生物系统发育特异性,团队进一步结合流式细胞分选技术与16S rRNA基因测序技术,创建了“APOL9-seq”策略,并对APOL9蛋白结合的肠道微生物进行了全面分析。研究结果显示,无论是在小鼠还是在人源微生物结合实验体系中,APOL9a/b及其人类同源物APOL2都表现出极强的群体选择性,几乎专一性地识别并结合拟杆菌目(Bacteroidales)细菌。
那么,APOL9/APOL2是如何实现对拟杆菌目细菌“精准锁定”的呢?研究人员猜测拟杆菌目细菌特有的细胞膜鞘脂组分可能介导该识别过程。随后,研究人员通过选取拟杆菌属的代表共生菌——多形拟杆菌(B.thetaiotaomicron)作为模式菌株,并利用基因编辑技术成功敲除其多个鞘脂生物合成相关基因。实验发现,APOL9/2蛋白对B. thetaiotaomicron的结合能力依赖于其细胞膜上的一类特殊脂质——神经酰胺-1-磷酸(Ceramide-1-phosphates, Cer1Ps)。一旦敲除Cer1P合成关键酶,APOL9/2与拟杆菌的结合能力明显下降,表明Cer1P是介导其识别的关键分子。这一结果首次揭示,宿主可通过识别共生菌特有脂质结构,从而精准“靶向”特定微生物群落。
有别于传统抗菌肽直接杀菌的方式,APOL9在生理浓度下与拟杆菌结合后并不引发细胞死亡,而是以一种非致死性的方式诱导这些革兰氏阴性菌释放大量外膜囊泡OMVs。这些OMVs直径在几十至数百纳米之间,富含细菌来源的脂类、蛋白和多糖等成分,因而可被宿主先天免疫系统识别并激活相应通路。功能实验进一步表明,这些由APOL9诱导产生的OMVs不仅能被宿主树突状细胞(Dendritic cell, DC)捕获,还能有效增强黏膜区域的IEC-T细胞互作介导的免疫反应。具体而言,它们通过激活干扰素-γ(IFN-γ)信号通路,显著提升小肠上皮细胞中MHC II类分子的表达水平,从而促进肠道上皮间一类具有重要免疫调节功能的CD4⁺CD8αα⁺ IEL的发育和维持。在体内功能验证层面,研究团队构建了Apol9a/b双敲除小鼠模型,并发现其小肠上皮的MHC-II分子及CD4⁺CD8αα⁺ IEL水平均发生下调,且这一调控现象依赖于小鼠肠道拟杆菌的存在。同时,在沙门氏菌(Salmonella typhimurium)经口感染实验中,研究人员也发现APOL9缺失小鼠不仅肠道局部病原负载显著升高,而且细菌易扩散至肝脏、脾脏等内脏器官,表现出更高的系统性感染风险和死亡率。相反,当给予这些小鼠拟杆菌来源的OMVs时,宿主的各项肠道免疫防御指标也显著提升,因而其感染症状也得到明显缓解。
这项研究不仅首次揭示了一类宿主新型载脂蛋白如何通过特异性识别共生菌膜脂分子并诱导其释放具有免疫调节活性OMVs的因果机理,还为我们理解宿主如何“主动塑造”肠道微生态提供了新的理论框架,同时也为开发下一代基于菌群精准调控的免疫干预手段奠定了分子基础。
中国科学院上海营养与健康研究所副研究员杨涛、博士研究生胡孝虎,与中国科学院分子细胞科学卓越创新中心博士研究生曹飞为论文的共同第一作者。中国科学院上海营养与健康研究所钱友存研究员和中国科学院分子细胞科学卓越创新中心宋昕阳研究员为文章共同通讯作者。该工作得到哈佛大学医学院Dennis L. Kasper教授、清华大学医学院梁冠翔教授、中国科学院分子细胞科学卓越创新中心石建涛研究员、中国科学院上海营养与健康研究所胡国宏研究员的支持和帮助。该工作得到了科技部国家重点研发计划项目、国家自然科学基金委、中国科学院B类先导专项、中国科学院“未来伙伴网络专项”及上海市科委项目的资助。 该工作同时获得中国科学院上海营养与健康研究所所级公共技术中心,中国科学院分子细胞科学卓越创新中心生信平台、化学生物学平台,中国科学院脑科学与智能技术卓越创新中心电镜平台,中国科学院上海免疫与感染研究所动物平台,上海交通大学流式平台,中科脂典公司及诺米代谢公司等多家单位、企业的技术支持。
论文链接: https://doi.org/10.1038/s41586-025-08990-4
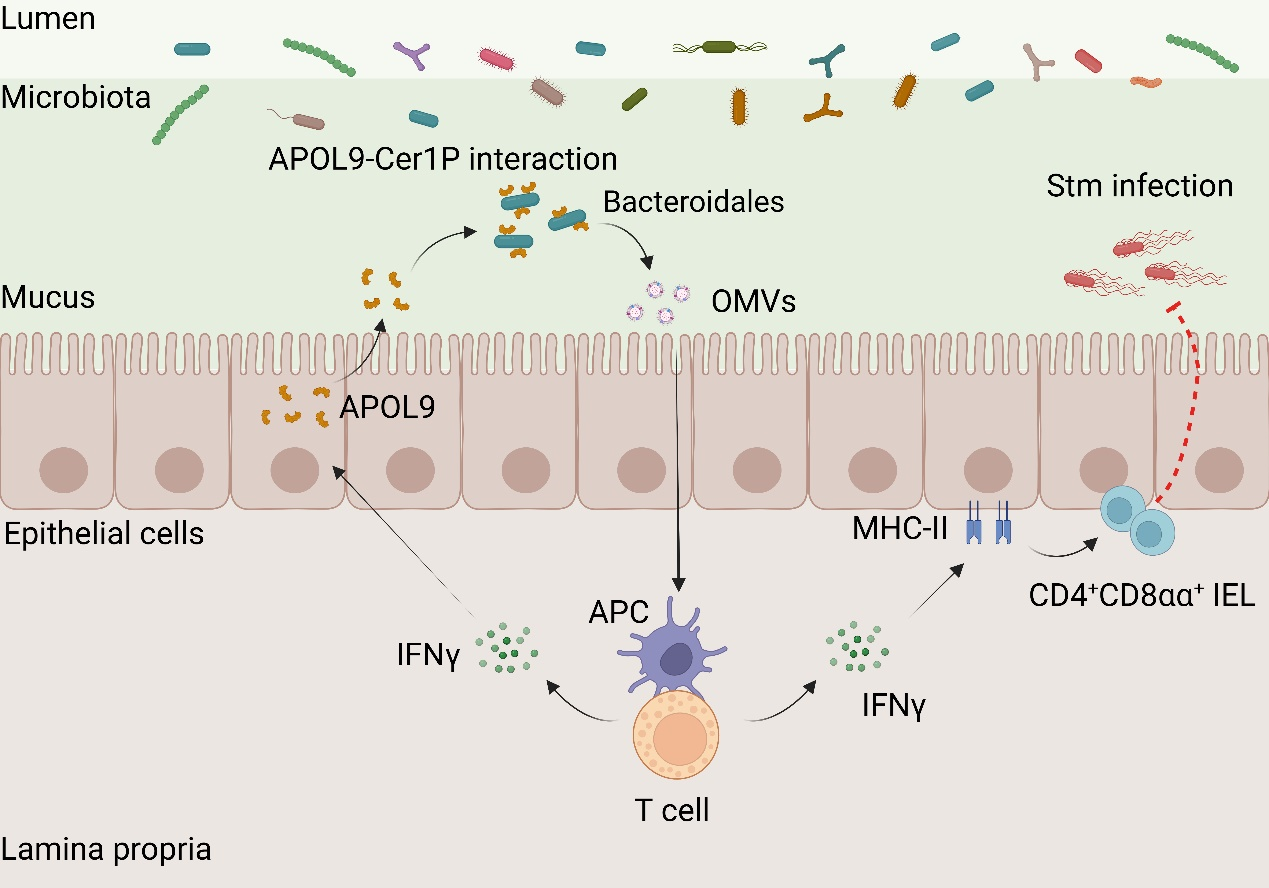
图:新型载脂蛋白APOL9通过结合拟杆菌Cer1P分子诱导OMVs释放并激活IFN-γ-MHC-II通路以增强肠道黏膜免疫