11月26日,国际学术期刊 Nature Aging在线发表了中国科学院上海营养与健康研究所肖意传研究组的合作研究成果,题目为”Age-related decline in CD8+ tissue resident memory T cells compromises antitumor immunity”。肖意传团队长期致力于免疫衰老与肿瘤免疫的调控机制探究,此研究发现衰老会导致肿瘤微环境中组织驻留CD8+ T细胞(Tissue Resident Memory, TRM)浸润明显减少,而这类细胞亚群被认为是一类具有高度抗肿瘤效应的CD8+ T细胞,这可能是衰老导致CD8+ T细胞功能障碍的关键机制。
人口老龄化已成为全球普遍现象,衰老相关疾病的防治已成为亟待解决的关键社会问题。伴随着衰老过程,人类患癌症的风险显著上升,据统计约有2/3的新发肿瘤患者的年龄大于65岁,衰老已成为肿瘤高发的关键因素。目前普遍接受的观点是个体衰老进程会导致DNA损伤和原癌基因的激活,进而会诱导细胞发生癌前病变。除此以外,越来越多的报道指出,免疫衰老是衰老个体共有的生理现象,它是伴随着年龄增长出现的免疫系统的退行性改变,是导致个体“免疫力”下降,进而诱发包括肿瘤等在内的疾病的关键原因。其中,T细胞是机体重要的免疫细胞之一,尤其是CD8+ T细胞作为抗肿瘤免疫的一线细胞,识别抗原后能直接对肿瘤细胞进行杀伤,在肿瘤免疫治疗中发挥了重要的调控作用。但是,衰老是如何影响CD8+ T细胞的功能及其介导的抗肿瘤效应的,机制尚不明确。
首先,为了研究衰老个体来源CD8+ T细胞的内在调控机制,研究人员分别分选了年轻和衰老个体来源的CD8+T细胞过继转移到Rag1-/-小鼠体内并诱导皮下肿瘤,对肿瘤浸润的CD8+T细胞进行单细胞测序分析发现,衰老组的TRM细胞浸润明显减少,于是研究人员猜测衰老个体来源的CD8+ T细胞其向TRM细胞分化的能力受到抑制,并通过体外分化实验验证了这一猜想。
为了进一步探究衰老导致TRM分化受到抑制的分子机制,通过多因素基因筛选发现,在老年个体来源CD8+ T细胞中,E3泛素连接酶BFAR的高表达会抑制TRM细胞的产生;在机制方面,E3泛素连接酶BFAR可通过直接介导去泛素化酶USP39的泛素化并使其活化,进而促进USP39对JAK2的去泛素化,从而抑制了细胞因子诱导的JAK-STAT信号通路的激活,最终导致TRM的分化的降低及其介导的机体抗肿瘤免疫反应的缺陷。特异性在CD8+ T细胞中敲除BFAR基因则显著促进了其在肿瘤微环境中向TRM的分化,进而增强了其抗肿瘤的免疫功能。
鉴于BFAR的这一功能,研究人员利用高通量药物筛选平台结合体外细胞功能实验分析,筛选获得了特异性靶向BFAR的小分子抑制剂iBFAR2,通过体外和体内实验都证明该小分子抑制剂可以模拟BFAR敲除的表型,即可显著促进CD8+ T细胞在肿瘤微环境中向TRM的分化,由此增强了CD8+ T细胞的抗肿瘤免疫功能,因此其可有效恢复老年个体来源的CD8+ T细胞的抗肿瘤免疫功能。
靶向PD-1/PD-L1免疫检查点阻断介导的免疫治疗,已成为晚期肿瘤治疗的新趋势,但是其受益肿瘤患者有限,有相当一部分晚期患者对此种疗法并不敏感。已有研究发现,T细胞衰老和PD-1/PD-L1抗体介导的肿瘤免疫治疗效果不佳有关。研究团队的结果也发现,利用筛选获得的BFAR小分子抑制剂iBFAR2可明显增加PD-1抗体介导的免疫治疗敏感性,且降低了利用高剂量PD-1抗体引起的系统性炎症的副作用。此外,iBFAR2还能有效抑制PD-1抗体不响应肿瘤的生长。因此,靶向BFAR不仅可以促进老年个体的抗肿瘤免疫应答,还可增敏PD-1抗体的肿瘤免疫治疗效果,并为临床PD-1抗体不响应患者的肿瘤免疫治疗提供新的策略。
综上所述,本研究揭示了衰老影响机体CD8+ T细胞抗肿瘤免疫反应的作用和分子机理,对衰老个体和PD-1抗体治疗不响应患者的肿瘤免疫防御能力缺陷的机制探究,进行了重要的补充。BFAR作为衰老调控的关键靶点,提示其对于临床老年患者肿瘤免疫治疗具有重要意义。
中国科学院上海营养与健康研究所副研究员裴思雨,博士生邓修瑜,中国科学院上海药物研究所杨瑞瑞,上海市胸科医院副研究员王慧和河北大学附属医院研究员史建红为该论文的第一作者。中国科学院上海营养与健康研究所肖意传研究员,中国科学院上海药物研究所郑明月研究员,上海市胸科医院罗清泉主任医师和河北工程大学倪志宇教授为论文的共同通讯作者。该工作得到了科技部、国家自然科学基金委和中国科学院的资助,同时也得到了中国科学院上海营养与健康研究所公共技术中心分析测试技术平台和实验动物技术平台的支持。
原文链接:https://www.nature.com/articles/s43587-024-00746-5
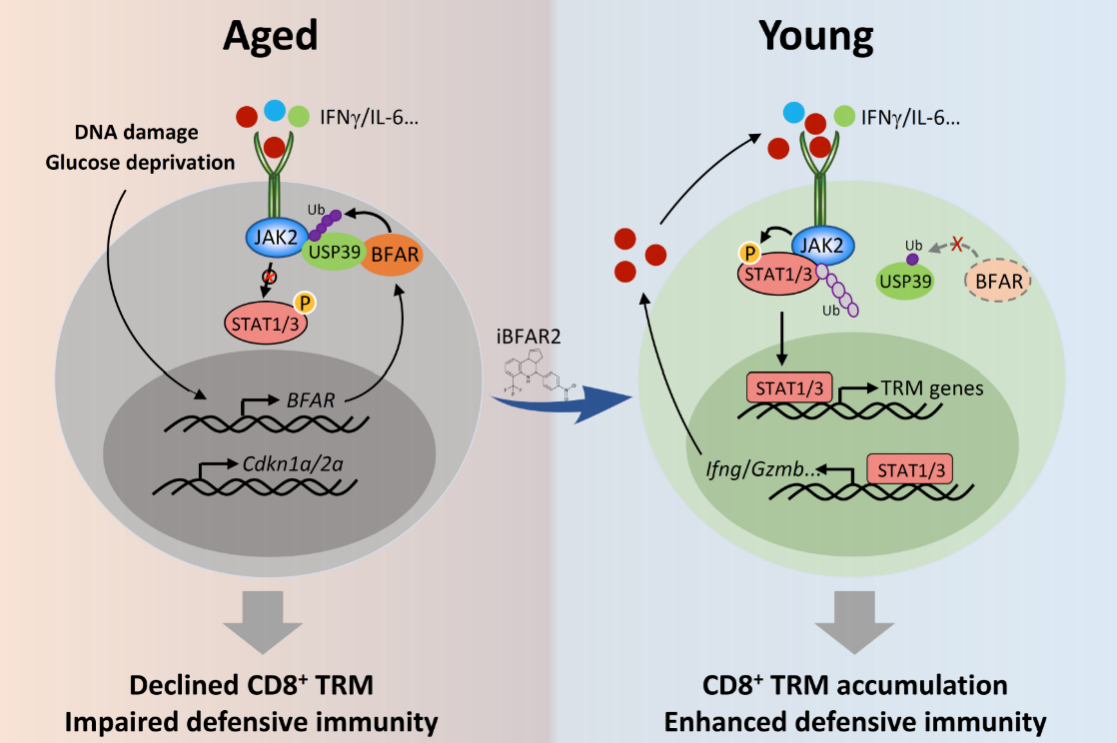
衰老抑制CD8+ T细胞介导的抗肿瘤免疫模式图