2017年4月13日,国际学术期刊Journal of Molecular Cell Biology在线发表了杨黄恬研究组题为“IP3R-mediated Ca2+ signals govern hematopoietic and cardiac divergence of Flk1+ cells via the calcineurin-NFATc3-Etv2 pathway”的最新研究发现。该研究揭示了IP3Rs家族在调控胚胎干细胞(ESCs)向造血和心肌谱系分化命运决定中的重要作用和其作用机制。
细胞分化命运的决定依赖于多种信号分子和转录因子精确而严格的调控。钙离子(Ca2+)是细胞内重要的第二信使,参与调控细胞的增殖、凋亡和分化等多种重要生理过程,但对其在哺乳类细胞的确切调控作用和调控通路了解甚少。ESCs具有自我更新和多能分化的特性,其向特定细胞分化过程重现了体内胚胎早期发育的时空特点和调控模式,因此是解析基因敲除导致胚胎致死基因在发育早期功能的独特体系,对ESCs分化机制的研究有助于认识胚胎发育的调控机制。三磷酸肌醇受体(IP3Rs)是内质网重要的Ca2+释放通道。小鼠(m)ESCs中存在三种IP3Rs亚型,亚型间功能既有特异性又存在代偿。此前杨黄恬研究团队发现IP3R3介导的Ca2+释放通过调控ESCs心肌前体细胞的凋亡影响ESC向心肌谱系的分化,但IP3Rs家族在ESCs特定谱系决定中的精细调控作用和机制尚未阐明。造血和心肌谱系均来自中胚层来源心脏/造血祖细胞(Flk1+)的分化,然而尚不清Flk1+细胞是受何种信号调控从而选择造血或心肌谱系分化的。
王毅洁博士和黄吉均博士等在杨黄恬研究员指导下发现ESCs自我更新和三胚层形成并不依赖于IP3Rs,然而造血中胚层(Flk1+/PDGFRa-)的出现依赖于IP3Rs介导的钙信号,这一钙信号的缺失抑制中胚层向造血谱系分化但促进其向心肌谱系的分化。在机制方面,IP3Rs释放的Ca2+而非细胞外的Ca2+内流通过激活钙调磷酸酶(calcineurin), 进而使得下游的NFATc3结合到调控造血发生的转录因子Etv2启动子促进其表达,进而诱导造血细胞分化而防止心肌细胞分化。研究发现并揭示了IP3Rs在ESCs向造血和心肌这两种具有同一胚层祖先的谱系命运决定中的重要作用,进一步证实Ca2+信号对于细胞命运调控的重要性和精确性。
该研究得到了来自国家自然科学基金委、科技部、中国科学院等项目的资助。参与此项工作合作者包括来自北京大学深圳研究生院欧阳昆富研究员和同济大学高绍荣教授团队;美国加州大学圣地亚哥分校的陈炬教授提供了Itpr1fl/fl2fl/fl3fl/fl小鼠。 (科技处)
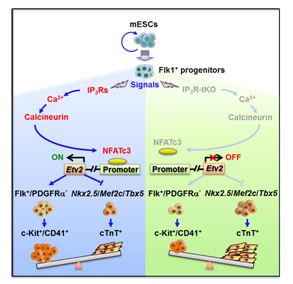
图1. IP3Rs释放的Ca2+通过calcineurin-NFATc3-Etv2信号通路,调控造血谱系和心肌谱系分化命运决定