11月2日,国际期刊Cell Reports在线发表了中国科学院上海营养与健康研究所钱友存研究组题为“Triggering endogenous Z-RNA sensing for anti-tumor therapy through ZBP1-dependent necroptosis”的最新研究成果。研究发现在氧化应激的条件下内源Z-RNA可以被诱导产生,并聚集于应激颗粒(stress granule)中,进而被Z型核酸结合蛋白ZBP1(Z-DNA binding protein 1)所识别,从而激活程序性细胞坏死(necroptosis)。此外,在肿瘤化疗治疗中,氧化应激诱导的Z-RNA激活ZBP1依赖的necroptosis也能明显促进肿瘤化疗的疗效。
具有左手双螺旋结构的核酸也被称为Z-型核酸,包括Z-DNA和Z-RNA,分别于1970和1984年被发现,然而关于Z-型核酸,尤其是Z-RNA在生理或病理中的功能和作用并不清楚。直到近几年,才有报道发现宿主细胞的ZBP1受体蛋白可以识别病毒来源的Z-RNA并诱导细胞程序性坏死来抑制病毒感染。此外,也有报道指出ZBP1可以识别宿主细胞潜在的Z-RNA来调节小鼠的器官发育和组织炎症。然而,宿主来源的Z-RNA是如何形成的,以及这些内源性Z-RNA是如何被ZBP1感知的,目前尚不清楚。由于Z-RNA是一种不稳定的RNA结构,细胞在一般的生理情况下不易产生,因此研究人员假设在特定的应激条件下,细胞中可能会产生并积累一定的Z-RNA。为了验证这个推测,研究人员通过利用识别Z-RNA的抗体进行斑点杂交实验来观察Z-RNA在不同应激条件下形成的情况,最后发现氧化应激如双氧水(H2O2)、亚砷酸盐(Arsenite)和顺铂(Cisplatin)能相对显著增加胞内的Z-RNA水平。进一步的研究发现Z-RNA的形成需要依赖氧化应激所产生的活性氧ROS。随后,借助Z-RNA抗体和重组的ZBP1 Z富集氧化应激之后生成的Z-RNA,通过转染方式发现这些Z-RNA能激活ZBP1-RIPK3-MLKL信号通路来激活程序性细胞坏死。
深入研究发现氧化应激诱导的Z-RNA主要分布在胞质中的应激颗粒中。同时发现应激颗粒作为氧化应激压力时形成的分子凝聚物,在控制Z-RNA激活ZBP1信号方面也发挥着关键作用。那这些内源的Z-RNA又是来自哪些RNA元件呢?为了回答这个问题,研究人员通过Z-RNA抗体和重组的ZBP1 Z进行了RIP-seq分析,发现氧化应激诱导的Z-RNA主要是来自内源逆转录原件。随后,研究人员通过皮下荷瘤模型实验进一步验证了氧化应激诱导的Z-RNA通过激活ZBP1依赖的程序性坏死增强了化疗药物对肿瘤生长的抑制效果。同时发现在人的多种肿瘤细胞中ZBP1的表达受到严重的抑制,在人类结肠癌细胞系HT-29中恢复ZBP1的表达能促进化疗对肿瘤生长的抑制作用。因而,研究人员推测在肿瘤细胞中诱导提高内源的ZBP1或外源性表达ZBP1可能会促进氧化应激类药物的临床治疗效果。
中国科学院上海营养与健康研究所博士后杨涛和博士生王国东为该论文的共同第一作者,钱友存研究员为该论文的通讯作者。该工作得到了科技部国家重点研发计划项目、国家自然科学基金委的资助,以及中国科学院上海营养与健康研究所所级公共技术中心分析测试技术平台、实验动物技术平台的支持。
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01389-X
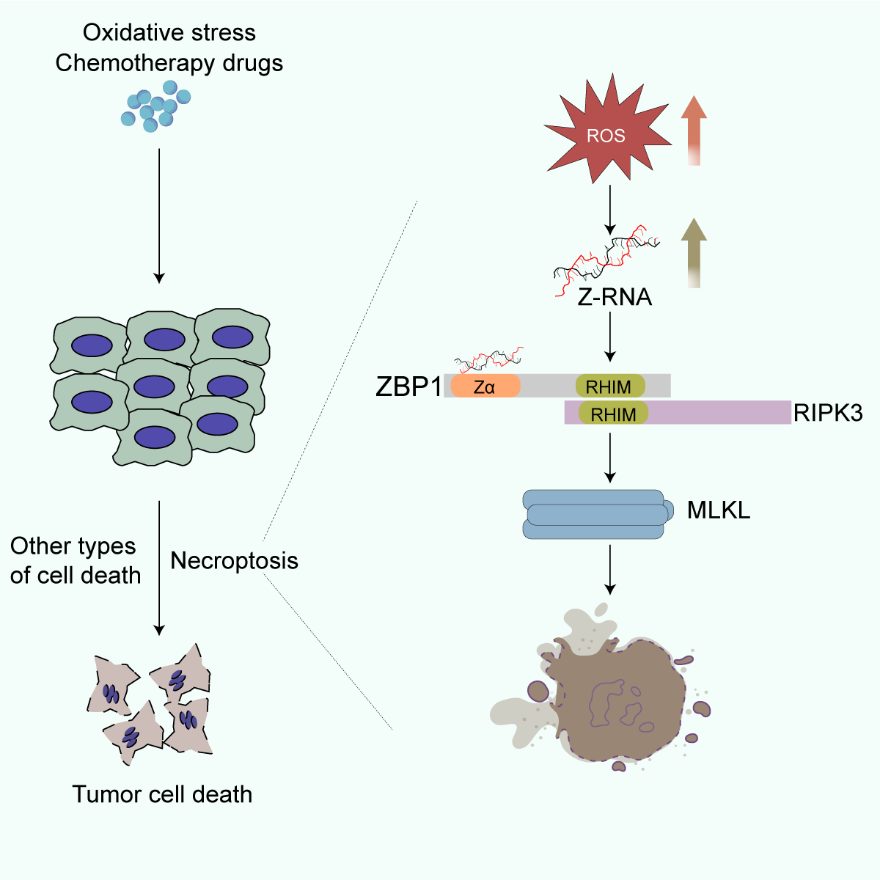
图注:氧化应激诱导的Z-RNA通过激活ZBP1依赖的程序性坏死增强肿瘤对化疗药物的敏感性