中国科学院上海营养与健康研究所、西南医科大学附属医院和青岛大学研究人员首次解析脯氨酸羟基化修饰调控2型糖尿病进展的新机制,揭示了脯氨酸羟化酶3(PHD3)通过羟基化增加糖异生关键转录因子CRTC2的核定位与活性,进而增加肝脏糖异生基因表达和葡萄糖产生。该研究成果于5月30日在《美国科学院院刊》(PNAS)在线发表。
肝脏作为重要的内分泌器官,肝脏糖代谢在维持机体血糖稳态中扮演着重要角色。肝脏糖异生过度增加是导致高血糖和2型糖尿病的重要原因。胰高血糖素的分泌会通过激活PKA通路和增加CREB的磷酸化来促进CREB与其转录辅因子CRTC2的结合,进而促进糖异生关键限速酶PEPCK和G6Pase的表达,增加糖异生水平。脯氨酸羟化酶PHD3能够通过感应氧气含量的变化来调节缺氧诱导因子HIF的羟基化水平,从而影响其活性。然而,PHD3能否感应机体其它生理状态变化并调控机体葡萄糖代谢与血糖稳态尚不清楚。
为了探究PHD3是否能够感应机体能量的变化,研究人员首先检测了正常饲喂和禁食状态下小鼠肝脏中PHD3的蛋白水平,发现禁食能显著增加PHD3的蛋白表达。利用PHD3肝细胞特异性敲除小鼠,分别进行禁食和高脂高蔗糖饮食喂养,发现无论是在禁食的生理状态还是肥胖的病理状态下,PHD3肝细胞特异性敲除均能降低小鼠肝脏中糖异生关键酶的表达水平和减少葡萄糖生成。其次,为了探究PHD3的作用是否通过其羟化酶活性来发挥,研究人员进一步构建了PHD3肝细胞羟化酶活性缺失的基因敲入(KI)小鼠模型,得到了和PHD3肝细胞特异性敲除小鼠一致的结果,表明PHD3参与糖异生的调控过程依赖其羟化酶活性。进一步的机制研究发现,PHD3通过羟基化CRTC2的Pro129和Pro625位点,促进CRTC2与CREB结合,增加CRTC2的核转位与转录活性,从而增加糖异生基因转录和葡萄糖生成。此外,CRTC2 Pro615位点的羟基化水平在禁食小鼠、ob/ob肥胖的糖尿病小鼠、糖尿病病人肝脏组织中均显著增加,这表明在生理和病理条件下,PHD3介导的CRTC2羟基化修饰可能在小鼠及人的血糖稳态调控中均发挥重要作用。
该研究发现糖异生关键转录因子CRTC2是PHD3新的下游底物,羟基化修饰增强了CRTC2的核转位与活性,从而增加糖异生基因的表达和肝糖输出。同时,该研究表明抑制肝脏PHD3或CRTC2羟基化可能是治疗高血糖和2型糖尿病的新策略。蛋白质翻译后修饰与2型糖尿病等代谢性疾病的发生和发展密切相关。李于研究组之前研究发现,AMPK通过磷酸化修饰脂质合成代谢关键因子Insig和SREBP,抑制肝脏脂质过度合成和非酒精性脂肪肝(Nat Commun, 2019; Cell Metab, 2013)。这些研究揭示蛋白翻译后修饰关键酶(如PHD3和AMPK)调节糖脂代谢紊乱的分子机制,为防治2型糖尿病和脂肪肝等代谢性疾病提供新的思路和治疗手段。
中国科学院上海营养与健康研究所李于研究员、西南医科大学附属医院付文广教授、青岛大学方靖教授为本论文通讯作者,中国科学院上海营养与健康研究所薛雅倩博士和崔奥媛副研究员为本论文第一作者。该研究得到国家科技部重点研发计划、国家自然科学基金委、上海市市级重大专项、代谢性血管疾病四川省重点实验室开放课题、山东省自然科学基金委、中国博士后科学基金的支持,同时得到中国科学院上海营养与健康研究所公共技术中心的支持。
研究论文链接:https://www.pnas.org/doi/10.1073/pnas.2219419120
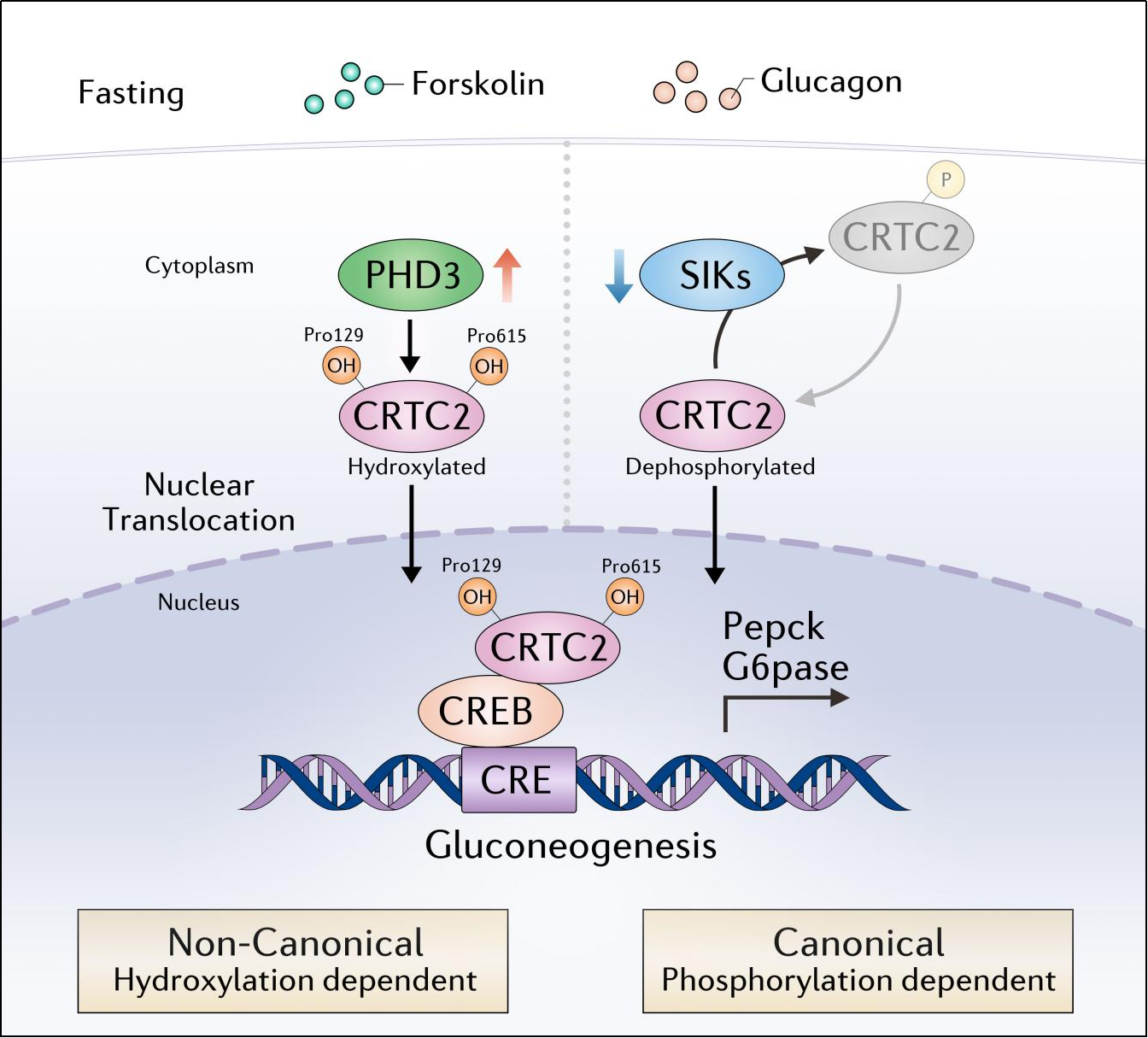
PHD3通过非经典的CRTC2羟基化修饰激活肝糖异生模式图
在禁食或胰高血糖素刺激条件下,PHD3结合并羟基化CRTC2的Pro129和Pro615位点,导致CRTC2的核转位和CREB/CRTC2途径激活,促进糖异生基因表达和肝糖输出。CRTC2羟基化是一种非经典的CRTC2翻译后修饰,独立于经典的CRTC2磷酸化修饰对肝脏糖异生的调控。