1月21日,中国科学院上海营养与健康研究所詹丽杏研究组合作在肝脏疾病研究领域取得重要突破,于国际学术期刊Journal of Hepatology在线发表了题为“AF6 knockout-induced upregulation of bile acid production promotes CXCL14-mediated antitumor immunity in HCC: Effect of the BA/Butyrate/CXCL14 axis in HCC”的研究成果, 揭示了胆汁酸代谢通过肠肝轴,介导新兴免疫趋化因子CXCL14调控肝脏抗肿瘤免疫微环境的新机制。
研究发现,初级胆汁酸/丁酸/CXCL14 形成代谢-免疫作用轴来改善肿瘤抑制性免疫微环境,从而抑制肝癌的进展。研究首次发现了极性蛋白 AF6 是肝上皮细胞胆汁酸合成酶的核心调控子,也明确了AF6 通过调控胆汁酸代谢稳态改善肝脏抑制性免疫微环境的作用机制。这些变化表征,为未来肝癌患者的临床治疗提供了新的治疗手段。
肝脏是人体的重要器官,承担营养代谢、胆汁分泌、解毒等代谢功能,胆汁的合成和分泌是肝脏最主要的功能之一。目前尚未有直接调控肝脏胆汁酸合成的小鼠模型,因此该研究也提供了解析机体胆汁酸相关病理生理调控的动物模型,具有重要意义。
詹丽杏研究团队既往有多项研究成果证实肝脏极性蛋白AF6与肝脏糖脂代谢密切相关。该研究首次报道了肝脏特异性敲除AF6可导致初级胆汁酸合成发生变化。通过一系列实验,研究人员证明了肝脏 AF6 是初级胆汁酸(BA)合成的核心调节因子,可直接调节 BA 合成途径中多种合成酶表达,特别是首步及限速酶细胞色素 P450 7A1(CYP7A1)。研究人员首先在二乙基亚硝胺(DEN)诱导的肝癌小鼠模型中,发现肝脏特异性敲除AF6可显著抑制肝癌进展,并增强了初级BA的生成。
极性蛋白AF6在肝脏中的特异性敲除是如何抑制肝癌进展的呢?研究人员猜测可能是通过肝脏局部机制或通过肠肝轴循环机制引起。通过宏基因组、靶向代谢组学检测等手段,研究人员进一步证明了AF6的特异性敲除导致了肠道微生物群和微生物代谢物的特征性变化,确认了是菌群代谢物丁酸的积累而非初级/次级胆汁酸的变化改变了肝肿瘤免疫微环境,这一效应是通过肠肝循环所介导。研究人员给予肝癌小鼠抗生素处理以消除肠肝轴中菌群及其代谢物带来的影响,证实菌群清除抵消了肝脏特异性敲除AF6引起的抗肿瘤作用。通过人肝癌类器官试验以及IHC等多种研究技术,研究人员发现丁酸能够上调肝细胞中趋化因子CXCL14 的表达和分泌。通过进一步的单细胞测序及体外共培养试验,研究证实肝细胞来源的CXCL14 能够招募活化的树突状细胞,从而促进并增强CD8 T细胞在肝癌中的细胞毒性作用。在多种肝癌模型中,研究验证了由肠肝循环进入肝脏的丁酸诱导的 CXCL14塑造了抑制肿瘤的免疫微环境,进而抑制了肝癌的进展。这项工作发现了不改变典型肝脏上皮完整性的情况下增强初级胆汁酸生成的小鼠模型,该模型可用于监测胃肠道中与胆汁酸相关的病理过程,包括癌症进展。
中国科学院上海营养与健康研究所博士研究生徐珂莹为该论文的第一作者;中国科学院上海营养与健康研究所詹丽杏研究员,江南大学医学中心夏加增教授,南京医科大学第一附属医院徐骁教授,长海医院李兆申教授和李刚教授为文章的共同通讯作者。该工作得到了中国科学院上海营养与健康研究所周章森研究员、胡国宏研究员、吕伟研究员和李昕研究员的支持与帮助,也得到了中国科学院上海营养与健康研究所所级公共技术中心分析测试技术平台和实验动物技术平台的支持。该工作获得了科技部、国家自然科学基金委等项目的资助。
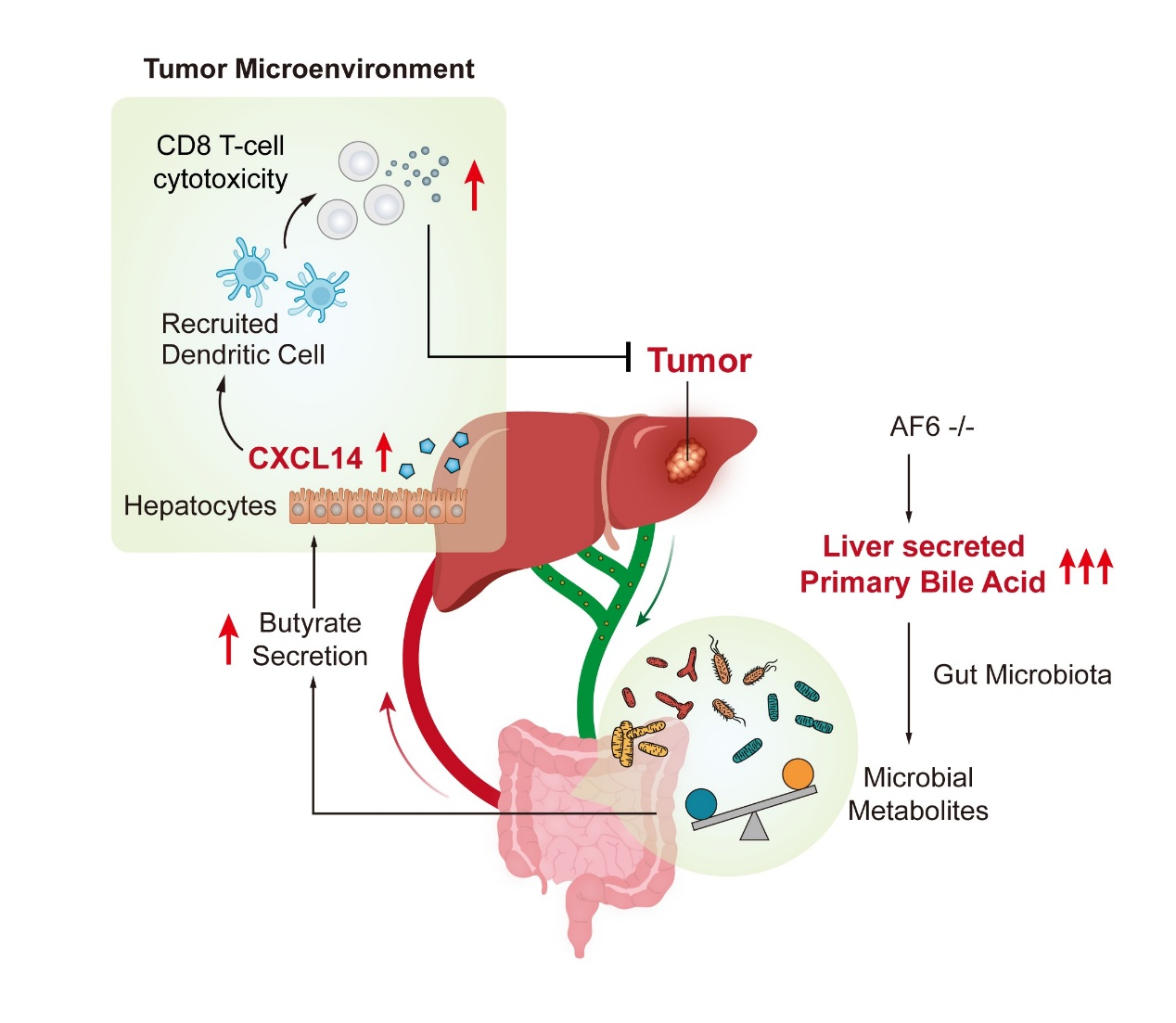
图:肝脏AF6 诱导胆汁酸代谢-免疫作用轴增强肝癌抗肿瘤免疫的机制示意图
论文链接:https://www.sciencedirect.com/science/article/pii/S0168827826000164
推送单元:詹丽杏研究组、科技规划与任务处