2022年
10月
6日,中国科学院上海营养与健康研究所孙宇研究团队在学术期刊
Oncogene正式发表了题为
“Targeting epiregulin in the treatment-damaged tumor microenvironment restrains therapeutic resistance”的研究论文。该研究发现了微环境中一种全新的衰老相关分泌因子在组织微环境中的产生基础以及其对肿瘤恶性进展的作用机制。
细胞衰老是一种独特的细胞状态,具有多种明确且稳定的细胞特征。其中,衰老相关分泌表型 (Senescence-associated secretory phenotype, SASP),使其在微环境中可对其他细胞发挥复杂的信号传递功能。在老年人群中,包括慢性炎症形成过程以及肿瘤微环境的局部空间内,SASP这一分泌表型对多种疾病的进展均造成不可忽视的病理作用。因而,研究SASP相关因子以及其在肿瘤等疾病的组织微环境中发挥功能的分子机制和干预途径,对老年疾病的临床治疗具有深远的指导意义。
该研究通过对人类原代基质细胞进行基于结合当前临床化疗胁迫压力的体外药物模拟处理,确认了epiregulin (EREG)在DNA损伤类型的衰老诱导条件下显著表达上调,而过往尚未有报道该因子与微环境中衰老细胞之间存在关联。同时,对临床前列腺癌及乳腺癌患者化疗前后癌症样本的分析,也发现EREG在衰老的癌旁基质细胞中显著上调表达。机制上,DNA损伤导致基质细胞中转录因子NF-κB等发生核转位并结合在EREG启动子区多个位点,进而促进EREG在细胞衰老后表达上调。同时,研究人员也注意到其他衰老相关因素包括:转录因子C/EBP激活,DNA空间开放度变化及表观遗传修饰改变对EREG转录起到促进作用。
在肿瘤微环境中,衰老细胞释放的EREG通过与其附近的癌细胞表面EGFR受体结合激活包括MAPK、AKT/mTOR及JAK/STAT等多条下游信号通路,从而诱发癌细胞增殖、迁移、侵袭等恶性表型,并最终造成癌细胞显著的耐药能力。通过RNA-Seq分析,研究人员发现了一种泛素连接酶MARCHF4在基质EREG激活的癌细胞中显著表达上调。MARCHF4可以使得癌细胞E-cadherin表达下调并抑制癌细胞凋亡,因而导致肿瘤耐药现象发生。在小鼠模型中,EREG单克隆抗体及EGFR单克隆抗体的联用显著降低肿瘤体积并显著延长了小鼠无病进展生存期。值得一提的是,癌症患者体内微环境中EREG的表达水平与其临床治疗后阶段的长期生存之间存在显著的负相关,并可作为对患者(包括多种癌型)预后的一个新型的标记物。
综上,这项工作深入发现并准确阐释了微环境中的衰老相关分泌因子EREG在肿瘤微环境中的病理功能及其调控机制,并揭示了其在将来转化医学和临床应用中的巨大潜力和重要价值。中科院上海营养与健康研究所博士生王常旭和复旦大学中山医院泌尿外科龙启来为该论文共同第一作者。上海营养与健康研究所孙宇研究员为该论文的通讯作者。该项工作得到了国家科学技术部、国家自然科学基金委、中科院战略性先导科技专项和上海市科委等部门的经费资助,以及营养与健康所所级中心公共技术平台的支持。
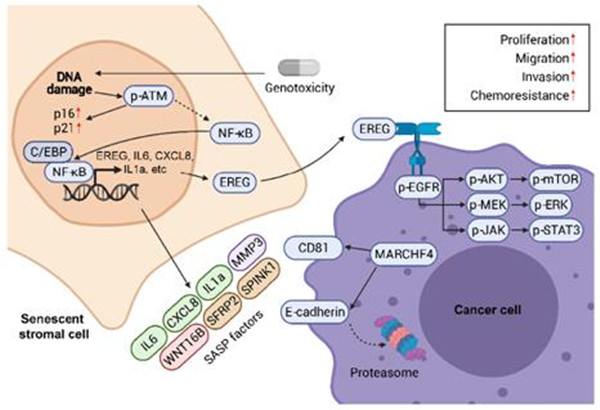
图注: 当代临床药物等治疗方式(尤其基因毒化疗)诱导损伤的肿瘤微环境中,基质细胞EREG表达上调并通过旁分泌方式激活附近癌细胞,促进其恶性表型并加速疾病进展;EREG将来可以作为患者疗后阶段的监测指标和临床抗癌治疗的新靶点。
论文链接:https://doi.org/10.1038/s41388-022-02476-7