2022年2月16日,国际学术期刊Nature Communications在线发表了中国科学院上海营养与健康研究所詹丽杏研究组题为“Lin28B-high breast cancer cells promote immune suppression in the lung pre-metastatic niche via exosomes and support cancer progression”的最新研究成果,阐释了多潜能因子Lin28B在乳腺癌转移前肺组织免疫微环境调控中的作用、机制和临床意义。
三阴性乳腺癌是恶性程度最高的乳腺癌亚型,临床上以侵袭性强、易复发和转移为主要表现。由于雌激素受体、孕激素受体和HER2 扩增的缺乏,使得其对内分泌治疗和靶向治疗均不敏感,目前主要依靠化疗和放疗,约40~50%患者在接受根治手术后仍出现复发和转移,患者平均5年生存率不足15%。因此研究乳腺癌尤其是三阴性乳腺癌早期转移机制,揭示干预新靶点是当前亟待解决的问题。
在肿瘤生长早期阶段,肺组织即可有肿瘤细胞到达,到达的肿瘤细胞有的处于生长停滞的静止状态,有的则启动转移灶的形成,那么发生转移的肺组织免疫微环境有什么规律呢?研究表明,肿瘤细胞的局部生长受到周围环境的调节,如肺基质细胞分泌的因子由于抑制肿瘤生长而使细胞处于休眠状态。那么,这些转移细胞的免疫监控是如何被抑制从而启动转移,并且原位肿瘤远程调控肺组织微环境及其免疫细胞活性状态的机制是什么,我们仍所知甚少。
在本研究中,研究人员首先依据人乳腺癌组织芯片样本和公共数据库信息,发现多潜能因子Lin28B的高表达与乳腺癌(特别是三阴性乳腺癌)患者预后不良密切相关,Lin28B高表达特异促进肺转移,与骨转移和脑转移无关。进一步,研究人员通过特定乳腺癌原位移植小鼠模型证明了Lin28B的促转移前免疫微环境抑制作用,而这是乳腺癌肺转移关键因素。机制上,他们发现,Lin28B表达使转移前肺组织中性粒细胞聚集增多和N2转化新机制,证实PD-L2和异常表达的细胞因子流调控N2转化的中性粒细胞增高,从而抑制转移前肺组织CD4+/CD8+ T细胞的增殖、活化和Th1分化,因而促进局部抑制性免疫微环境形成。在此基础上,他们发现原发肿瘤外泌体足以诱导转移前肺组织免疫抑制和肺转移发生,Lin28B表达使原位肿瘤内ALDH+干细胞比例上调,这群细胞分泌的外泌体由包含低含量的let-7s家族成员,导致转移前肺组织成纤维细胞、中性粒细胞和巨噬细胞分别释放增多的CXCLs、IL-6和IL-10,由此引起中性粒细胞召集和N2转化。因此,当采用IL-6和PD-L2的联合干预,明显解除转移前肺组织的免疫抑制,抑制Lin28B引起的肺转移,表明免疫抑制是Lin28B引起肺转移的关键机制以及早期机制。
综上,该研究发现Lin28B经外泌体途径,调节转移前肺组织细胞因子表达进而改变中性粒细胞表型和T细胞免疫状态产生肺转移的作用机理。由于Lin28B在三阴性乳腺癌中的广泛表达,本研究也提示,免疫抑制可能是三阴性乳腺癌肺转移早期微环境普遍存在的机制,这一线索为免疫治疗方法干预肺早期微环境提供了新思路。
中国科学院上海营养与健康研究所詹丽杏研究员为该论文通讯作者,祁美艳副研究员和华中科技大学附属同济医院甲乳外科夏耘副主任医师为共同第一作者。该研究获得了国家重点研发计划项目、国家自然科学基金委项目、恩施州科技计划研究与开发等项目的资助。
文章链接:https://www.nature.com/articles/s41467-022-28438-x
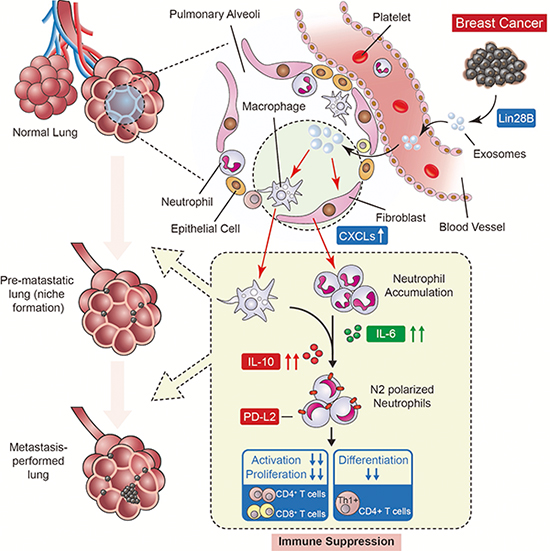
图注:Lin28B通过外泌体调节转移前肺组织免疫抑制促进乳腺癌转移新机制