2023年3月3日,国际学术期刊Cell Regeneration在线发表了中国科学院上海营养与健康研究所丁秋蓉研究组的研究文章“Modeling drug-induced liver injury and screening for anti-hepatofibrotic compounds using human PSC-derived organoids”。该研究开发了衍生自人类多能干细胞(hPSCs)的人肝脏器官(HLOs)在药物安全性评估和抗纤维化药物高通量筛选方面的应用。
新药研发的高失败率众所周知。据国际药物研发中心(CMR)发布的《2020年CMR药物研发评估报告》显示:2010年至2020年间,从I期临床实验开始的药物研发项目上市成功率低于10%。研发失败的主要原因是缺乏足够的疗效或安全性,占临床II期失败项目的73%,及临床III期失败项目的69%。由于动物和人的种属间差异,依赖动物实验预测药物的临床疗效、毒性及药代动力学参数(PK)等,不可避免的造成预测的偏差,最终导致大量药物开发失利。开发能够准确评估和预测候选药物对人体肝组织毒性和疗效的体外肝脏细胞模型迫在眉睫。衍生自人类多能干细胞(hPSCs)的人肝脏器官(HLOs)提供了一个可行的解决方案。
在该工作中,通过诱导人多能干细胞定向分化,获得了具备多种肝脏细胞类型的体外肝脏类器官模型(HLOs)。该HLOs中包含了肝脏中的多种细胞谱系,如肝细胞、胆管细胞、星状细胞和Kupffer细胞等,可用于模拟多种类型的药物性肝损伤(DILI)和一些复杂肝病如胆汁淤积、非酒精性脂肪肝等。通过应用对乙酰氨基酚、氟尿苷、甲氨蝶呤和TAK-875等工具化合物处理HLOs,研究人员检测到包括肝细胞损伤、脂肪变性、纤维化和Kupffer细胞介导的特异性DILI等不同类型的DILI表型,并且发现HLOs反映的药物性肝损伤与临床的数据间有良好的一致性。
在此基础上,研究人员进一步设计了一套高内涵分析系统,使用TGFβ诱导的HLOs纤维化模型进行高通量的抗纤维化药物筛选。采用Collagen I免疫荧光染色反映纤维化程度,每孔样品提取16个高内涵特征读数进行tSNE分析。分析结果用于疗效评估。选择了60个化合物进行测试,其中10个化合物在筛选中显示出潜在的抗纤维化功效。进一步验证了被筛选出的化合物中的4个化合物,其中2个化合物SD208和Imatinib显示出明显的抗纤维化效果。为了提高评估系统的敏感性和稳定性,研究人员同时建立了不同处理方法诱导的HLOs纤维化模型,模拟由不同病因诱发的肝纤维化以确认药物功效。最终,研究人员发现SD208可以显著减少TGFβ、MTX或LPS处理诱发的肝纤维化。研究成果证实了该系统可开发为一个简单、方便、高效的抗纤维化药物筛选平台。
综上所述,研究人员开发了hPSC衍生的HLOs在药物安全性评估和抗纤维化药物高通量筛选方面的应用。未来的工作将围绕上述人源肝细胞模型的细致功能刻画和药物筛选体系的进一步优化展开,结合HLO肝纤维化模型和人源化小鼠模型进一步探讨抗纤维化药物的详细机制,以期为解决临床前药物肝毒性和有效性不能被充分评估等迫在眉睫的问题提供更多的启示。
中国科学院上海营养与健康研究所博士生吴晓珊为该论文第一作者,丁秋蓉研究员为该论文通讯作者,李爽博士为该论文共同通讯作者。中国科学院上海营养与健康研究所博士生蒋大程也参与了这项研究工作。该研究工作得到了国家自然科学基金、中国科学院战略性先导科技专项、上海市科学技术委员会、中国博士后科学基金和中科院青年创新促进会等的资助,以及中国科学院上海营养与健康研究所公共技术平台的支持。
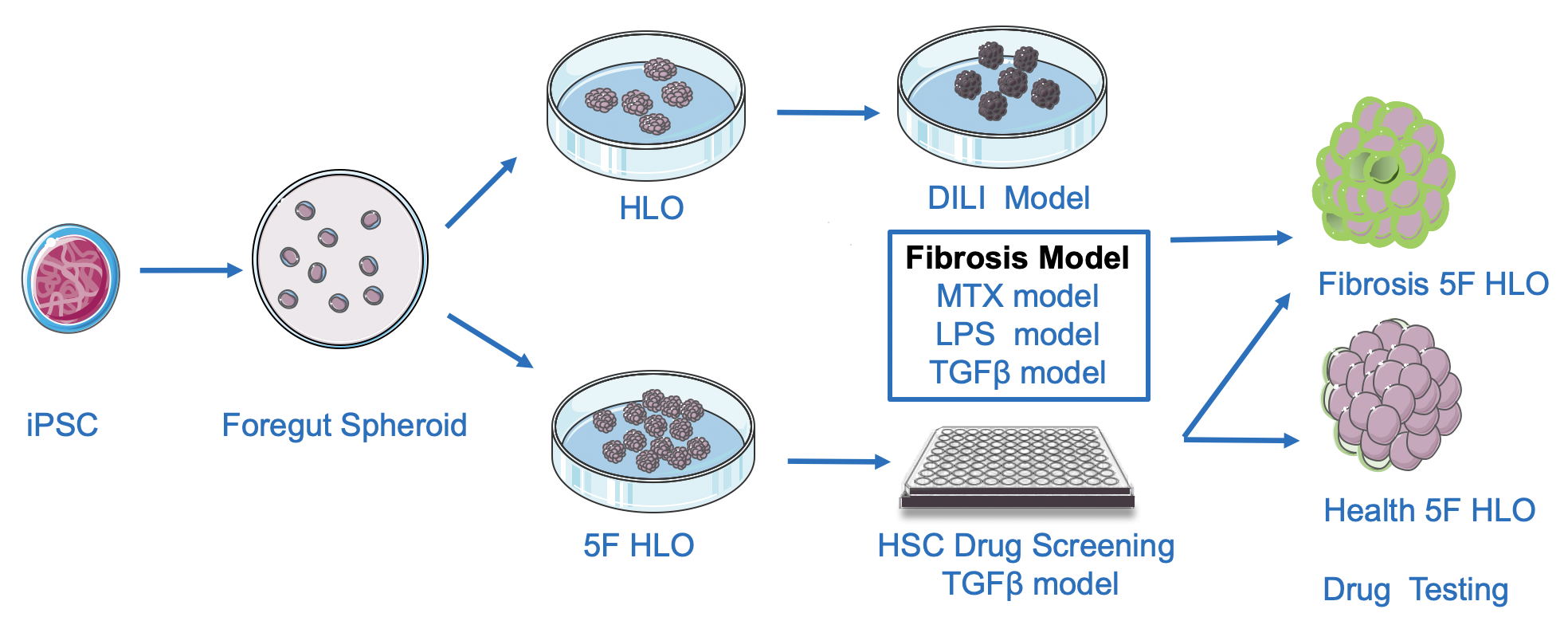
图:人iPSC衍生的肝类器官应用于药物肝毒性评估及抗肝纤维化药物的筛选
文章链接:https://cellregeneration.springeropen.com/articles/10.1186/s13619-022-00148-1