2021年5月13日,中国科学院上海营养与健康研究所孙宇研究组经合作研究在Nature Aging杂志在线发表了题为“KDM4 Orchestrates Epigenomic Remodeling of Senescent Cells and Potentiates the Senescence-Associated Secretory Phenotype”的研究论文。该工作综合运用有限酶解和同位素标记定量蛋白质组学、染色质可及性测序(ATAC-seq)和染色质免疫共沉淀测序(ChIP-seq)等表观遗传学高通量技术,揭示了衰老细胞组蛋白表观遗传修饰的普遍特征、染色质空间开放的变化规律和KDM4等表观分子的重要作用及其在人类衰老过程中的靶向价值。
研究人员组首先通过全蛋白质组学研究手段全景式分析并发现了人类衰老细胞有大约700多个胞浆与核内蛋白发生了表达水平或翻译后修饰等深刻变化,其中400多个是可量化的。在87个显著上调和29个显著下调的蛋白中,尤其值得关注的是H3K27和H3K36这两个位点三甲基化和二甲基化水平的同步降低。由于组蛋白翻译后修饰可以改变染色质的结构,并与衰老细胞相关表型的表观遗传调控有关,研究人员随后重点解析了组蛋白H3位点发生系统性或一致性改变的可能性,并阐述了它们是否与细胞在衰老阶段的特殊表型之间有潜在、深层乃至至今未知的因果关系。
进一步研究发现,KDM4家族在细胞衰老过程中经常出现上调态势,其中A和B两个分子最具显著性。在大量临床肿瘤患者样本中,上调KDM4A/B和下调H3K9/H3K36甲基化(me2/me3)与疗后阶段患者的生存率呈显著负相关。通过转录组绘制的染色质可及性图谱和通过全基因组数据绘制的表达图谱,系统展示了染色质开放度的全局性变化和转录组景观式时空重编程的特有规律,而这些都是与衰老相关分泌表型(senescence-associated secretory phenotype, SASP)发生发展紧密相关的事件。
在衰老领域,该研究首次揭示了人类细胞在衰老过程中出现的组蛋白H3位点表观修饰的生物学意义,产生了衰老细胞的高精度染色体空间可及性图谱资源;利用涵盖3D基因组的表观多组学分析,发现了衰老细胞特异性的去甲基化酶表达规律和多套SASP相关转录调控元件,为阐明衰老伴随的表观因子动态变化和作用机制提供了新思路、新视野和新证据。杂志同期配发了专题评论(news & Views),重点阐述核心数据为将来衰老生物学和老年医学的纵深推进所提供的关键线索。
中国科学院上海营养与健康研究所张博逸博士为论文的第一作者,孙宇研究员和滨州医学院付强教授为论文的共同通讯作者。研究工作得到中国科学院、国家自然科学基金委、国家科技部和上海市科委等科研基金的资助。
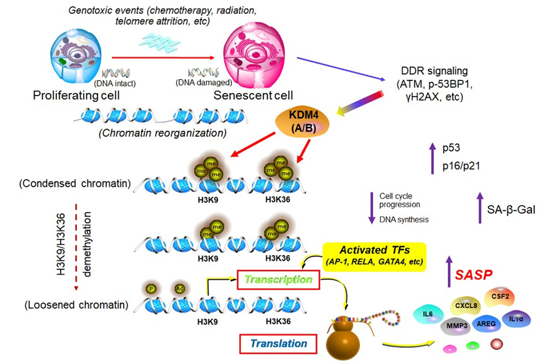
图.KDM4介导的表观修饰在衰老细胞中引起全基因组3D空间变化和染色质拓扑重塑最终造成SASP持续性高度表达