2019年2月28日,Science(《科学》)发表了一篇名为“Cytosine base editor generates substantial off-target single nucleotide variants in mouse embryos”(《单碱基编辑会导致难以预测的脱靶性单核苷酸突变》)的研究论文,该研究由中国科学院神经科学研究所(简称神经所)、中国科学院脑科学与智能技术卓越创新中心和中国科学院上海营养与健康研究所隶属的计算生物学研究所(中国科学院-马普学会计算生物学伙伴研究所,简称计算生物学所)、斯坦福大学遗传学系以及中国农业科学院深圳农业基因组研究所合作完成。该研究建立了一种被命名为GOTI的新型脱靶检测技术,并使用该技术发现新兴的单碱基编辑技术有可能导致无法预测的脱靶,因而存在风险。此研究显著提高基因编辑技术的脱靶检测敏感性,并且不借助于任何脱靶位点预测技术,可以发现之前的脱靶检测手段无法发现的完全随机的脱靶位点,为基因编辑工具的安全性评估带来了突破性的新工具,有望成为新的行业检测标准。
作为新一代基因编辑工具,CRISPR/Cas9自从2012年被发明以来,一直以其高效性和特异性备受世人的期待和广泛关注,学术界普遍认为基于CRISPR/Cas9及其衍生工具的临床技术将为人类的健康做出巨大贡献。然而值得注意的是,CRISPR/Cas9从问世以来,其脱靶风险也一直备受关注,如果将CRISPR/Cas9及其衍生工具用于临床的话,脱靶效应可能会引起包括癌症在内的很多种副作用,因此一种能够突破之前限制的脱靶检测技术,将会成为CRISPR/Cas9及其衍生工具是否能最终走上临床的关键。
在此之前,人们推出过多种检测脱靶的方案,然而之前的技术大多都依赖于未必十分准确的脱靶位点预测,并且会引入大量噪音的体外扩增,这导致人们一方面难以顾及预测位点以外的脱靶情况,另一方面又很难将脱靶信号从背景噪音中分离出来,因此关于CRISPR/Cas9及其衍生工具的真实脱靶率一直存在争议。人们希望可以找到一种既能够不依赖于脱靶位点预测,又能有足够信噪比的精密脱靶检测手段。
为了实现这一目标,李亦学研究组与合作者建立了一种名叫GOTI的脱靶检测技术。在小鼠受精卵分裂到二细胞期的时候,编辑一个卵裂球,并使用红色荧光蛋白标记。在小鼠胚胎发育到14.5天时,将整个小鼠胚胎消化成为单细胞,利用流式细胞分选技术基于红色荧光蛋白,分选出基因编辑细胞和没有基因编辑细胞,全基因组测序比较两组差异。这样就避免了单细胞体外扩增带来的噪音问题。由于实验组和对照组来自同一只小鼠,理论上基因背景完全一致,因此直接比对两组细胞的基因组,其中的差异基本就可以认为是基因编辑工具造成的。
在与合作单位的共同努力下,GOTI系统被成功建立了起来。借助于这个系统,团队成员先是检测了最经典的CRISPR/Cas9系统,结果发现,设计良好的CRISPR/Cas9并没有明显的脱靶效应,这个结果结束了之前对于CRISPR/Cas9脱靶率的争议。然而团队还检测了另一个同样被给予厚望的CRISPR/Cas9衍生技术BE3,这个系统可以精确引入点突变,在之前的研究中从未发现过有明显的脱靶问题。然而在GOTI的检测下发现,BE3存在非常严重的脱靶,这些脱靶由于大多出现在传统脱靶预测认为不太可能出现脱靶的位点,之前一直没有发现其脱靶的严重问题。团队分析后认为,这些脱靶位点有部分出现在抑癌基因上,因此经典版本的BE3有着很大的隐患,不适合作为临床技术。
在基于GOTI技术的脱靶检测中,团队发现以BE3为代表的部分基因编辑技术存在无法预测的脱靶风险,让世人重新审视了这些新兴技术的风险。更重要的是,此工作建立了一种在精度、广度和准确性上远远超越之前的基因编辑脱靶检测技术,达到了目前理论和技术水平所能达到的最高程度,有望由此建立新的行业标准。
该项工作主要由中国科学院脑科学与智能技术卓越创新中心/神经科学研究所博士后左二伟、中国科学院分子细胞科学卓越创新中心/生化与细胞所博士研究生孙怡迪、计算生物学所研究员魏武、中国农业科学院深圳农业基因组研究所助理研究员袁堂龙等在神经所杨辉研究员、计算生物学所李亦学研究员、斯坦福大学Lars M. Steinmetz教授的指导下完成,并得到了神经所流式分选平台的的大力协助,是众多研究组通力合作的重要成果。本工作得到国家高科技研发项目(2018YFC2000100与2017YFC1001302 to Yang Hui, 2017YFC0908405 to WW),中科院战略性先导科技专项(XDB32060000),国家自然科学基金委员会(31871502, 31522037),上海市科技重大项目(2018SHZDZX05),上海市科学技术委员会项目(18411953700, 18JC1410100),美国国立卫生研究院P01项目(P01HG00020527)等项目的资助。
原文链接:https://doi.org/10.1126/science.aav9973
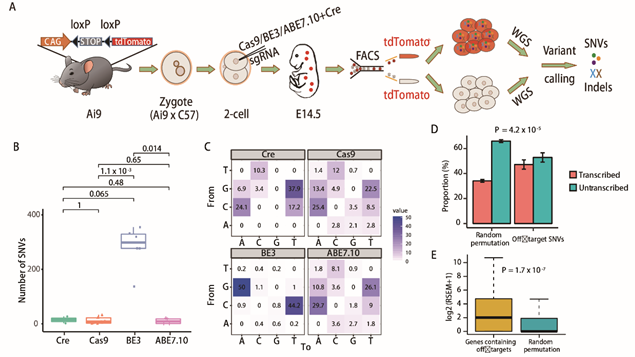
(A)实验流程 (B)脱靶位点数目比较。Cre-, Cas9-, BE3- and ABE7.10组分别有14+/-12 (SEM, n=2), 12+/-4 (SEM, n=11), 283+/-32 (SEM, n=6)和10 +/- 5 (SEM, n = 4)个SNVs (C)突变类型的分布比较。每个格子中的数字表示该种突变类型占全部突变的比例 (D)脱靶SNVs富集在基因组中的转录区域 (E)Genes包含脱靶位点的基因在细胞胚胎中有更高的表达量。